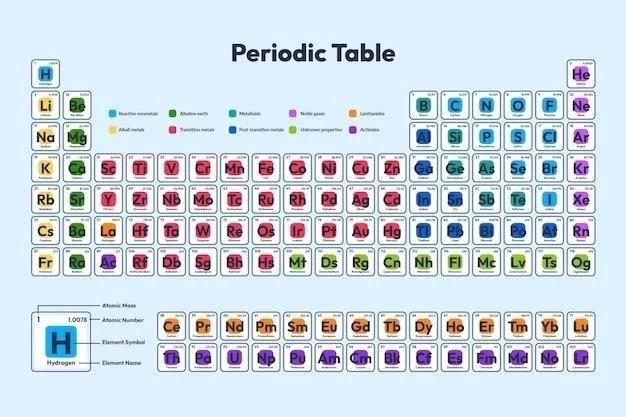
Introduction à la Classification des Éléments Chimiques
La chimie est l’étude de la matière et de ses propriétés‚ ainsi que de la façon dont la matière change. La classification des éléments chimiques est une étape fondamentale en chimie‚ car elle permet de comprendre les relations entre les éléments et de prédire leurs propriétés.
Le tableau périodique est un outil essentiel en chimie‚ car il organise les éléments chimiques en fonction de leurs propriétés. Il nous permet de visualiser les relations entre les éléments et de prédire leurs comportements.
1.1 La Science de la Chimie et l’Importance de la Classification
La chimie est une science fondamentale qui étudie la matière et ses transformations. Elle explore la composition‚ la structure‚ les propriétés et les réactions des substances. Au cœur de cette discipline se trouve la notion d’élément chimique‚ qui représente la forme la plus simple de la matière. Les éléments sont les blocs de construction de l’univers‚ et leur compréhension est essentielle pour déchiffrer le monde qui nous entoure. La classification des éléments chimiques est donc une étape cruciale en chimie‚ car elle permet d’organiser ces entités fondamentales en fonction de leurs propriétés et de leurs comportements. Cette organisation systématique facilite l’étude des éléments‚ permet de prédire leurs réactions et de comprendre les interactions entre eux.
1.2 Le Tableau Périodique ⁚ Un Outil Fondamental pour Comprendre la Matière
Le tableau périodique des éléments‚ souvent appelé simplement “tableau périodique”‚ est un outil indispensable en chimie. Il représente une organisation systématique de tous les éléments chimiques connus‚ classés en fonction de leur numéro atomique croissant et de leurs propriétés chimiques récurrentes. Chaque élément occupe une case unique dans le tableau‚ contenant son symbole chimique‚ son numéro atomique‚ sa masse atomique et d’autres informations essentielles. La structure du tableau périodique révèle des tendances périodiques‚ c’est-à-dire des variations régulières des propriétés des éléments en fonction de leur position dans le tableau. Ces tendances permettent de prédire le comportement chimique des éléments‚ d’identifier les relations entre eux et de comprendre les interactions qui conduisent à la formation de composés.
Le Tableau Périodique ⁚ Structure et Organisation
Les éléments sont les constituants fondamentaux de toute matière. Ils sont définis par leur nombre de protons‚ appelé numéro atomique‚ qui les distingue les uns des autres.
Le tableau périodique est organisé en colonnes verticales appelées groupes et en lignes horizontales appelées périodes. Les éléments d’un même groupe partagent des propriétés chimiques similaires.
Les éléments d’une même famille‚ comme les métaux alcalins ou les halogènes‚ présentent des caractéristiques communes en raison de leur configuration électronique similaire.
2.1 Les Éléments ⁚ Les Blocs de Construction de la Matière
Les éléments sont les constituants fondamentaux de toute matière. Chaque élément est défini par son numéro atomique‚ qui représente le nombre de protons présents dans le noyau de son atome. Ce nombre est unique à chaque élément et le distingue de tous les autres. Par exemple‚ l’hydrogène (H) a un numéro atomique de 1‚ ce qui signifie qu’il possède un seul proton dans son noyau. L’hélium (He)‚ quant à lui‚ a un numéro atomique de 2‚ indiquant la présence de deux protons dans son noyau.
Les éléments sont les blocs de construction de la matière‚ et ils se combinent de différentes manières pour former des molécules et des composés. La compréhension des éléments est donc essentielle pour comprendre la composition et les propriétés de la matière.
2.2 Les Groupes et les Périodes ⁚ Organisation des Éléments
Le tableau périodique est organisé en colonnes verticales appelées “groupes” et en rangées horizontales appelées “périodes”. Les groupes sont numérotés de 1 à 18‚ et les éléments d’un même groupe partagent des propriétés chimiques similaires en raison de leur nombre d’électrons de valence‚ c’est-à-dire les électrons présents dans la couche électronique externe de l’atome. Par exemple‚ les éléments du groupe 1‚ les métaux alcalins‚ ont tous un électron de valence‚ ce qui explique leur réactivité élevée.
Les périodes‚ quant à elles‚ correspondent aux niveaux d’énergie des électrons. Les éléments d’une même période ont le même nombre de couches électroniques‚ ce qui influence leur taille et leur comportement chimique. Ainsi‚ les éléments de la première période ont un seul électron dans leur couche électronique‚ tandis que ceux de la deuxième période en ont deux‚ et ainsi de suite.
2.3 Familles d’Éléments ⁚ Propriétés Similaires et Comportements Prévisibles
Au sein du tableau périodique‚ certains groupes d’éléments présentent des propriétés chimiques similaires et des comportements prévisibles‚ formant ainsi des “familles” d’éléments. Parmi les familles les plus notables‚ on trouve les métaux alcalins (groupe 1)‚ les métaux alcalino-terreux (groupe 2)‚ les halogènes (groupe 17) et les gaz nobles (groupe 18). Les métaux alcalins‚ par exemple‚ sont tous des métaux doux et réactifs qui réagissent facilement avec l’eau pour former des hydroxydes. Les halogènes‚ quant à eux‚ sont des non-métaux réactifs qui forment facilement des ions négatifs (anions).
La classification des éléments en familles permet de comprendre et de prédire leurs propriétés chimiques‚ ce qui est essentiel pour la recherche et le développement de nouvelles technologies.
Classification des Éléments ⁚ Métaux‚ Non-métaux et Métalloïdes
Les métaux sont généralement brillants‚ malléables‚ ductiles et bons conducteurs de chaleur et d’électricité. Ils sont utilisés dans une grande variété d’applications‚ allant des structures de bâtiments aux appareils électroniques.
Les non-métaux présentent des propriétés variées‚ mais ils sont généralement mauvais conducteurs de chaleur et d’électricité. Ils sont utilisés dans de nombreuses applications‚ notamment dans les industries pharmaceutiques et agricoles.
Les métalloïdes‚ également appelés semi-conducteurs‚ présentent des propriétés intermédiaires entre les métaux et les non-métaux. Ils sont utilisés dans la fabrication de composants électroniques‚ tels que les transistors et les puces informatiques.
3.1 Les Métaux ⁚ Propriétés et Applications
Les métaux se distinguent par un ensemble de propriétés caractéristiques qui les rendent uniques et précieux pour diverses applications. Ils sont généralement brillants‚ c’est-à-dire qu’ils réfléchissent la lumière‚ ce qui leur confère un aspect lustré. De plus‚ ils sont malléables‚ ce qui signifie qu’ils peuvent être façonnés en feuilles minces‚ et ductiles‚ c’est-à-dire qu’ils peuvent être tirés en fils. Cette combinaison de propriétés les rend particulièrement adaptés à la construction et à la fabrication.
Les métaux sont également d’excellents conducteurs de chaleur et d’électricité. Cette propriété est exploitée dans de nombreux domaines‚ tels que la fabrication de fils électriques‚ de casseroles et de poêles‚ et de systèmes de chauffage et de refroidissement. En outre‚ les métaux sont souvent utilisés comme catalyseurs dans des réactions chimiques‚ accélérant les réactions sans être consommés.
3.2 Les Non-métaux ⁚ Caractéristiques Distinctives et Utilisations
Contrairement aux métaux‚ les non-métaux présentent des propriétés physiques et chimiques distinctes. Ils ne sont généralement pas brillants et peuvent être opaques ou transparents. Leur malléabilité et leur ductilité sont limitées‚ ce qui signifie qu’ils ne peuvent pas être facilement façonnés en feuilles ou en fils. De plus‚ les non-métaux sont de mauvais conducteurs de chaleur et d’électricité‚ ce qui les rend utiles comme isolants.
Les non-métaux jouent un rôle crucial dans la vie et l’industrie. L’oxygène‚ par exemple‚ est essentiel à la respiration et à la combustion. L’azote est un composant essentiel des protéines et de l’ADN. Le chlore est utilisé pour la désinfection de l’eau potable. Le carbone est la base de la vie organique et est utilisé dans de nombreuses applications‚ notamment les plastiques‚ les médicaments et les combustibles.
3.3 Les Métalloïdes ⁚ Un Pont Entre les Métaux et les Non-métaux
Les métalloïdes‚ également appelés semi-métaux‚ présentent des propriétés intermédiaires entre les métaux et les non-métaux. Ils peuvent avoir l’apparence des métaux‚ mais leurs propriétés conductives sont plus proches de celles des non-métaux. Certains métalloïdes‚ comme le silicium‚ sont semi-conducteurs‚ ce qui signifie qu’ils peuvent conduire l’électricité dans certaines conditions‚ mais pas dans d’autres. Cette propriété les rend essentiels dans l’électronique‚ notamment dans la fabrication de puces informatiques;
D’autres métalloïdes‚ comme l’arsenic et l’antimoine‚ sont utilisés dans des alliages‚ des pesticides et des médicaments. Le bore‚ un autre métalloïde‚ est utilisé dans la fabrication de verres résistants à la chaleur et dans les réacteurs nucléaires. Les métalloïdes illustrent la complexité de la classification des éléments et la possibilité de propriétés intermédiaires.
Propriétés et Tendances Périodiques
Le tableau périodique révèle des tendances systématiques dans les propriétés des éléments‚ permettant de prédire leur comportement chimique.
4.1 Électronégativité ⁚ L’Attraction pour les Électrons
L’électronégativité‚ souvent représentée par le symbole (χ)‚ mesure la capacité d’un atome à attirer des électrons lorsqu’il est lié à un autre atome. Plus l’électronégativité d’un élément est élevée‚ plus il attire fortement les électrons vers lui. Cette propriété est fondamentale pour comprendre la nature des liaisons chimiques et la polarité des molécules.
Dans le tableau périodique‚ l’électronégativité augmente généralement de gauche à droite dans une période et de bas en haut dans un groupe. Les éléments les plus électronégatifs se trouvent en haut à droite du tableau‚ tandis que les éléments les moins électronégatifs se trouvent en bas à gauche.
L’électronégativité est un facteur déterminant dans la formation des liaisons ioniques et covalentes. Lorsque deux atomes d’électronégativité très différente se lient‚ l’atome le plus électronégatif attire fortement les électrons‚ formant une liaison ionique. En revanche‚ lorsque deux atomes d’électronégativité similaire se lient‚ les électrons sont partagés plus équitablement‚ formant une liaison covalente.
4.2 Énergie d’Ionisation ⁚ La Facilité à Perdre un Électron
L’énergie d’ionisation‚ notée $IE$‚ représente l’énergie minimale requise pour arracher un électron d’un atome gazeux à l’état fondamental‚ formant ainsi un ion positif. Cette énergie est exprimée en électron-volts (eV) ou en kilojoules par mole (kJ/mol). Plus l’énergie d’ionisation est élevée‚ plus il est difficile d’enlever un électron de l’atome‚ et donc plus l’atome est stable.
Dans le tableau périodique‚ l’énergie d’ionisation augmente généralement de gauche à droite dans une période et de bas en haut dans un groupe. Les éléments situés en haut à droite du tableau ont des énergies d’ionisation élevées‚ car leurs électrons de valence sont fortement attirés par le noyau. À l’inverse‚ les éléments situés en bas à gauche du tableau ont des énergies d’ionisation faibles‚ car leurs électrons de valence sont moins liés au noyau.
L’énergie d’ionisation est une propriété importante pour comprendre le comportement chimique des éléments. Elle permet de prédire la capacité d’un élément à former des ions et à participer à des réactions chimiques.
4.3 Rayon Atomique ⁚ La Taille des Atomes
Le rayon atomique‚ généralement mesuré en picomètres (pm)‚ représente la distance entre le noyau d’un atome et son électron le plus externe. Cette grandeur est difficile à définir précisément car les électrons ne sont pas localisés à des positions fixes. On utilise souvent le rayon covalent‚ qui correspond à la moitié de la distance entre les noyaux de deux atomes liés par une liaison covalente‚ ou le rayon métallique‚ qui correspond à la moitié de la distance entre les noyaux de deux atomes métalliques adjacents dans un réseau cristallin.
Dans le tableau périodique‚ le rayon atomique augmente généralement de droite à gauche dans une période et de haut en bas dans un groupe. Cette tendance est due à l’augmentation du nombre de couches électroniques et à la diminution de l’attraction entre le noyau et les électrons de valence.
Le rayon atomique est un facteur important pour comprendre les propriétés chimiques des éléments‚ notamment leur capacité à former des liaisons chimiques et leur réactivité.
4.4 Configuration Électronique ⁚ L’Arrangement des Électrons
La configuration électronique d’un atome décrit la distribution des électrons sur les différents niveaux d’énergie et sous-niveaux d’énergie autour du noyau. Elle est représentée par une notation qui indique le nombre d’électrons dans chaque niveau et sous-niveau. Par exemple‚ la configuration électronique de l’atome d’oxygène est $1s^22s^22p^4$‚ ce qui signifie qu’il a 2 électrons sur le niveau d’énergie 1‚ 2 électrons sur le niveau d’énergie 2 et 4 électrons sur le sous-niveau $2p$.
La configuration électronique détermine les propriétés chimiques d’un élément‚ notamment sa réactivité‚ sa capacité à former des liaisons chimiques et son comportement dans les réactions chimiques. Les éléments qui ont des configurations électroniques similaires ont souvent des propriétés chimiques similaires‚ ce qui explique l’organisation du tableau périodique en groupes et en périodes.
La compréhension de la configuration électronique est essentielle pour prédire et expliquer les propriétés chimiques des éléments.
Liaison Chimique et Formation de Composés
Les atomes s’assemblent pour former des molécules et des composés en partageant ou en transférant des électrons‚ ce qui crée des liaisons chimiques.
5.1 Liaisons Ioniques ⁚ Transfert d’Électrons
Les liaisons ioniques résultent du transfert d’un ou plusieurs électrons d’un atome à un autre. Cet échange d’électrons crée des ions‚ des atomes chargés électriquement. Les atomes qui perdent des électrons deviennent des cations‚ chargés positivement‚ tandis que ceux qui gagnent des électrons deviennent des anions‚ chargés négativement. La force d’attraction électrostatique entre les ions de charges opposées forme la liaison ionique. Par exemple‚ le sodium (Na) perd un électron pour former un cation Na+‚ tandis que le chlore (Cl) gagne un électron pour former un anion Cl–. Ces ions s’attirent pour former le composé ionique chlorure de sodium (NaCl)‚ communément appelé sel de table.
5.2 Liaisons Covalentes ⁚ Partage d’Électrons
Contrairement aux liaisons ioniques‚ les liaisons covalentes impliquent le partage d’électrons entre les atomes. Les atomes impliqués dans une liaison covalente partagent un ou plusieurs paires d’électrons‚ créant une force d’attraction qui maintient les atomes liés ensemble. Cette force d’attraction est due à la concentration d’électrons entre les noyaux des atomes. Par exemple‚ dans la molécule de dihydrogène (H2)‚ chaque atome d’hydrogène partage son électron unique avec l’autre atome d’hydrogène‚ formant une liaison covalente simple. Les liaisons covalentes peuvent être simples‚ doubles ou triples‚ selon le nombre de paires d’électrons partagées.
5.3 Liaisons Métalliques ⁚ Un “Nuage” d’Électrons
Les liaisons métalliques sont un type de liaison chimique unique qui se produit entre les atomes métalliques. Dans les métaux‚ les électrons de valence‚ les électrons les plus externes‚ ne sont pas liés à un atome particulier‚ mais plutôt délocalisés dans tout le réseau métallique. Ces électrons libres forment un “nuage” d’électrons qui se déplace librement entre les noyaux des atomes métalliques. Cette délocalisation des électrons explique les propriétés caractéristiques des métaux‚ telles que la conductivité électrique et thermique élevée‚ la malléabilité et la ductilité. La liaison métallique est responsable de la cohésion des atomes métalliques et de la formation de structures solides et compactes;
Composés‚ Mélanges et Solutions
6.1 Composés ⁚ Combinaison d’Éléments
Les composés sont formés par la combinaison chimique de deux ou plusieurs éléments dans un rapport fixe.
6.2 Mélanges ⁚ Association de Substances
Les mélanges sont des combinaisons physiques de deux ou plusieurs substances qui ne sont pas chimiquement liées.
6.3 Solutions ⁚ Mélanges Homogènes
Les solutions sont des mélanges homogènes où une substance est dissoute dans une autre.
L’article offre une introduction accessible à la classification des éléments chimiques. La présentation du tableau périodique est bien structurée et informative. L’accent mis sur l’importance de la classification pour comprendre les relations entre les éléments est pertinent. Cependant, il serait souhaitable d’intégrer des éléments visuels (schémas, illustrations) pour rendre l’apprentissage plus attractif et plus facile à assimiler.
L’article présente une introduction claire et concise à la classification des éléments chimiques. La description du tableau périodique est précise et bien structurée. L’accent mis sur l’importance de la classification pour prédire les réactions chimiques est pertinent. Cependant, il serait intéressant d’aborder les différentes méthodes de classification des éléments et de discuter de leurs avantages et de leurs inconvénients.
L’article offre une introduction accessible à la classification des éléments chimiques. La présentation du tableau périodique est claire et concise. L’accent mis sur l’importance de la classification pour comprendre les relations entre les éléments est pertinent. Cependant, il serait souhaitable d’intégrer des exercices et des questions pour permettre aux lecteurs de tester leur compréhension et de consolider leurs connaissances.
L’article offre une introduction solide à la classification des éléments chimiques. La présentation du tableau périodique est claire et concise. L’accent mis sur l’importance de la classification pour comprendre les relations entre les éléments est pertinent. Cependant, il serait souhaitable d’aborder les implications de la classification des éléments pour la recherche scientifique et pour les applications technologiques.
Cet article offre une introduction claire et concise à la classification des éléments chimiques. La présentation du tableau périodique comme un outil fondamental pour comprendre la matière est particulièrement pertinente. L’accent mis sur l’importance de la classification pour prédire les réactions chimiques est également un point fort. Cependant, il serait intéressant d’approfondir les différents types de classifications des éléments (par exemple, les classifications par électronégativité ou par rayon atomique) et de développer davantage les liens entre la classification et les propriétés chimiques.
L’article présente une introduction solide à la classification des éléments chimiques. La description du tableau périodique est claire et concise. L’accent mis sur l’importance de la classification pour prédire les réactions chimiques est pertinent. Cependant, il serait intéressant d’aborder les limites de la classification actuelle et d’évoquer les défis liés à la découverte de nouveaux éléments et à leur intégration dans le tableau périodique.
L’article aborde de manière efficace les notions fondamentales de la classification des éléments chimiques. La description du tableau périodique est précise et accessible à un large public. La mise en avant de l’importance de la classification pour comprendre les relations entre les éléments est un point positif. Cependant, il serait judicieux d’illustrer le texte avec des exemples concrets de réactions chimiques et de propriétés des éléments pour rendre l’apprentissage plus dynamique et plus engageant.
L’article aborde de manière claire et concise les notions fondamentales de la classification des éléments chimiques. La description du tableau périodique est précise et bien illustrée. L’accent mis sur l’importance de la classification pour prédire les réactions chimiques est un point fort. Cependant, il serait intéressant d’évoquer les applications concrètes de la classification des éléments dans différents domaines, tels que la médecine, l’industrie ou l’environnement.
L’article offre une introduction solide à la classification des éléments chimiques. La présentation du tableau périodique est claire et concise. L’accent mis sur l’importance de la classification pour comprendre les relations entre les éléments est pertinent. Cependant, il serait souhaitable de développer davantage la notion de périodicité des propriétés chimiques et d’illustrer ce concept avec des exemples concrets.
L’article aborde de manière efficace les notions fondamentales de la classification des éléments chimiques. La description du tableau périodique est précise et bien illustrée. L’accent mis sur l’importance de la classification pour prédire les réactions chimiques est un point fort. Cependant, il serait intéressant d’aborder les liens entre la classification des éléments et les autres branches de la science, telles que la physique ou la biologie.