La Théorie Atomique de Dalton
La théorie atomique de Dalton, proposée au début du XIXe siècle, a révolutionné notre compréhension de la matière. Elle repose sur neuf postulats fondamentaux qui ont jeté les bases de la chimie moderne.
Introduction
Avant le XIXe siècle, la nature de la matière était un mystère. Les philosophes grecs avaient proposé l’idée d’atomes, mais cette notion restait spéculative. C’est John Dalton, un chimiste et physicien anglais, qui a révolutionné notre compréhension de la matière en formulant sa théorie atomique en 1803. Cette théorie, basée sur des observations expérimentales et des raisonnements logiques, a jeté les bases de la chimie moderne.
La théorie atomique de Dalton postule que la matière est composée de particules indivisibles et indestructibles appelées atomes. Ces atomes sont les unités fondamentales de la matière, et ils ne peuvent être ni créés ni détruits. La théorie de Dalton a permis d’expliquer un certain nombre de lois chimiques fondamentales, telles que la loi de conservation de la masse, la loi des proportions définies et la loi des proportions multiples. Elle a également fourni un cadre pour comprendre les réactions chimiques et la composition des composés.
Bien que la théorie atomique de Dalton ait été modifiée et affinée au cours des siècles suivants, ses postulats fondamentaux restent valables aujourd’hui. La théorie atomique est l’un des concepts les plus importants de la science, et elle a contribué à notre compréhension de l’univers à l’échelle microscopique.
Les Postulats de la Théorie Atomique de Dalton
La théorie atomique de Dalton se base sur neuf postulats fondamentaux qui décrivent la nature de la matière et son comportement. Ces postulats, énoncés au début du XIXe siècle, ont révolutionné notre compréhension de la chimie et ont jeté les bases de la science moderne.
- Postulat 1⁚ La matière est composée d’atomes. La matière est constituée de particules minuscules et indivisibles appelées atomes. Ces atomes sont les unités fondamentales de la matière et ne peuvent être ni créés ni détruits.
- Postulat 2⁚ Les atomes d’un élément donné sont identiques. Tous les atomes d’un élément donné ont la même masse et les mêmes propriétés. Par exemple, tous les atomes d’hydrogène sont identiques en masse et en propriétés.
- Postulat 3⁚ Les atomes d’éléments différents ont des masses différentes. Les atomes d’éléments différents ont des masses différentes. Par exemple, un atome d’oxygène est plus lourd qu’un atome d’hydrogène.
- Postulat 4⁚ Les atomes ne peuvent être ni créés ni détruits. Les atomes ne peuvent être ni créés ni détruits lors d’une réaction chimique. Ils sont simplement réarrangés.
- Postulat 5⁚ Les composés sont formés par la combinaison d’atomes de différents éléments dans des rapports numériques simples. Les composés sont formés par la combinaison d’atomes de différents éléments dans des rapports numériques simples et constants. Par exemple, l’eau est toujours formée de deux atomes d’hydrogène pour un atome d’oxygène ($H_2O$).
- Postulat 6⁚ Les réactions chimiques impliquent la réorganisation des atomes. Les réactions chimiques impliquent la réorganisation des atomes. Les atomes ne sont ni créés ni détruits, mais ils sont réarrangés pour former de nouvelles molécules.
Postulat 1⁚ La matière est composée d’atomes
Ce postulat fondamental de la théorie atomique de Dalton stipule que la matière est constituée de particules minuscules et indivisibles appelées atomes. Ces atomes sont les unités fondamentales de la matière, les briques élémentaires qui composent tout ce qui nous entoure. En d’autres termes, la matière n’est pas continue, mais plutôt granulaire, constituée de ces atomes discrets.
Cette idée révolutionnaire a remis en question la vision de la matière comme un continuum, une idée dominante à l’époque. Dalton a proposé que la matière est en réalité composée de particules distinctes, les atomes, qui ne peuvent être ni créés ni détruits. Cette notion d’indivisibilité des atomes a été fondamentale pour le développement de la chimie moderne.
Le postulat 1 a jeté les bases de notre compréhension de la structure de la matière. Il a permis d’expliquer les lois de conservation de la masse, des proportions définies et des proportions multiples, qui étaient des observations empiriques inexpliquées auparavant. La théorie atomique de Dalton a ainsi apporté un cadre théorique solide pour l’étude de la matière, ouvrant la voie à de nouvelles découvertes et à une compréhension plus profonde de la nature.
Postulat 2⁚ Les atomes d’un élément donné sont identiques
Ce postulat établit que tous les atomes d’un élément chimique donné sont identiques en termes de masse et de propriétés. En d’autres termes, tous les atomes de carbone, par exemple, ont la même masse et les mêmes propriétés chimiques, quelles que soient leur origine ou leur état physique. Cette uniformité des atomes d’un même élément est cruciale pour comprendre le comportement chimique de la matière.
Le postulat 2 implique que les atomes d’un élément sont des entités fondamentales, immuables et identiques entre elles. Il permet d’expliquer pourquoi les éléments chimiques présentent des propriétés spécifiques et constantes. Par exemple, l’or est toujours jaune et malléable, car tous les atomes d’or ont les mêmes propriétés. Cette constance des propriétés chimiques est essentielle pour la classification des éléments et pour la compréhension des réactions chimiques.
Il est important de noter que ce postulat a été remis en question par la découverte des isotopes, des atomes du même élément ayant des masses différentes. Cependant, le postulat 2 reste valable dans le sens où les isotopes d’un élément ont les mêmes propriétés chimiques, même si leurs masses varient. La théorie atomique de Dalton a ainsi posé les bases de notre compréhension des éléments chimiques et de leur comportement.
Postulat 3⁚ Les atomes d’éléments différents ont des masses différentes
Ce postulat fondamental de la théorie atomique de Dalton établit que les atomes des différents éléments chimiques possèdent des masses distinctes. Autrement dit, un atome d’hydrogène n’a pas la même masse qu’un atome d’oxygène, et ainsi de suite. Cette distinction de masse est essentielle pour comprendre la composition et les propriétés des composés chimiques.
Le postulat 3 permet d’expliquer pourquoi les éléments chimiques ont des propriétés différentes. Par exemple, l’hydrogène est un gaz léger et inflammable, tandis que l’oxygène est un gaz plus dense et indispensable à la combustion. Ces différences de propriétés découlent de la différence de masse entre les atomes d’hydrogène et d’oxygène.
La notion de masse atomique, définie comme la masse d’un atome d’un élément chimique, est une conséquence directe de ce postulat. La masse atomique est une propriété fondamentale des éléments chimiques et elle est utilisée pour calculer la masse moléculaire des composés chimiques. La découverte des isotopes, des atomes du même élément ayant des masses différentes, a conduit à une définition plus précise de la masse atomique, mais le postulat 3 reste fondamental pour comprendre la diversité des éléments chimiques et leur comportement.
Postulat 4⁚ Les atomes ne peuvent être ni créés ni détruits
Ce postulat, connu sous le nom de loi de conservation de la masse, est l’un des piliers fondamentaux de la chimie. Il stipule que dans une réaction chimique, la masse totale des réactifs est égale à la masse totale des produits. En d’autres termes, les atomes ne peuvent pas être créés ou détruits, mais seulement réorganisés.
Ce postulat a des implications profondes sur notre compréhension des réactions chimiques. Il signifie que la matière n’est pas perdue ou gagnée lors d’une transformation chimique, mais simplement réorganisée. Par exemple, lors de la combustion du bois, le bois et l’oxygène réagissent pour former du dioxyde de carbone, de la vapeur d’eau et des cendres. La masse totale des produits est égale à la masse totale du bois et de l’oxygène.
Le postulat 4 a été confirmé par de nombreuses expériences scientifiques et il est à la base de nombreuses lois de la chimie, telles que la loi des proportions définies et la loi des proportions multiples. Il a également joué un rôle crucial dans le développement de la théorie atomique moderne, qui a permis de comprendre la structure de la matière à l’échelle atomique.
Postulat 5⁚ Les composés sont formés par la combinaison d’atomes de différents éléments dans des rapports numériques simples
Ce postulat explique la composition des composés chimiques et constitue la base de la loi des proportions définies. Il stipule que les composés sont formés par la combinaison d’atomes de différents éléments dans des rapports numériques simples et fixes. Par exemple, l’eau est toujours composée de deux atomes d’hydrogène (H) pour un atome d’oxygène (O), quelle que soit la source de l’eau. Cette formule chimique, $H_2O$, représente la composition constante de l’eau.
Le postulat 5 a des implications importantes pour la compréhension des réactions chimiques. Il explique pourquoi les composés ont des propriétés spécifiques et constantes. Par exemple, le sel de table (chlorure de sodium, NaCl) a toujours un goût salé, car il est composé d’un rapport fixe de sodium (Na) et de chlore (Cl). Ce postulat a également permis de développer la notion de formule chimique, qui représente la composition d’un composé.
Ce postulat est essentiel pour la compréhension de la chimie moderne. Il permet de prédire et de contrôler les réactions chimiques, de synthétiser de nouveaux composés et de comprendre la structure et les propriétés de la matière.
Postulat 6⁚ Les réactions chimiques impliquent la réorganisation des atomes
Ce postulat fondamental établit que les réactions chimiques ne créent ni ne détruisent des atomes, mais qu’elles modifient simplement les liaisons entre eux. En d’autres termes, les atomes se réorganisent pour former de nouvelles molécules ou de nouvelles structures. Ce postulat est étroitement lié à la loi de conservation de la masse, qui stipule que la masse totale des réactifs est égale à la masse totale des produits dans une réaction chimique.
Prenons l’exemple de la combustion du méthane ($CH_4$), un gaz naturel. La réaction chimique peut s’écrire comme suit⁚
$CH_4 + 2O_2 ightarrow CO_2 + 2H_2O$
Dans cette réaction, les atomes de carbone (C), d’hydrogène (H) et d’oxygène (O) ne sont pas détruits ni créés. Ils sont simplement réorganisés. Un atome de carbone, quatre atomes d’hydrogène et quatre atomes d’oxygène des réactifs se retrouvent dans les produits sous forme de dioxyde de carbone ($CO_2$) et d’eau ($H_2O$).
Le postulat 6 est crucial pour comprendre la nature des réactions chimiques et pour prédire les produits d’une réaction donnée. Il est également à la base de la stœchiométrie, qui étudie les quantités de matière impliquées dans les réactions chimiques.
Postulat 7⁚ Les atomes d’un élément donné sont identiques en masse et en propriétés
Ce postulat établit que tous les atomes d’un même élément chimique ont la même masse et les mêmes propriétés. Il est important de noter que ce postulat a été par la suite modifié par la découverte des isotopes. Les isotopes sont des atomes du même élément qui ont le même nombre de protons, mais un nombre différent de neutrons. Ainsi, les isotopes d’un même élément ont des masses différentes. Cependant, les propriétés chimiques des isotopes sont très similaires, car elles sont principalement déterminées par le nombre de protons.
Par exemple, le carbone (C) a deux isotopes naturels ⁚ le carbone-12 ($^{12}C$) et le carbone-14 ($^{14}C$). Le carbone-12 a 6 protons et 6 neutrons, tandis que le carbone-14 a 6 protons et 8 neutrons. Le carbone-12 est l’isotope le plus abondant et constitue la base de l’échelle des masses atomiques. Le carbone-14 est un isotope radioactif utilisé pour la datation au radiocarbone.
Malgré la découverte des isotopes, le postulat 7 de Dalton reste un principe fondamental de la théorie atomique. Il souligne l’importance de la notion d’élément chimique, défini par le nombre de protons dans son noyau atomique.
Postulat 8⁚ Les atomes sont les particules les plus petites d’un élément qui peuvent exister
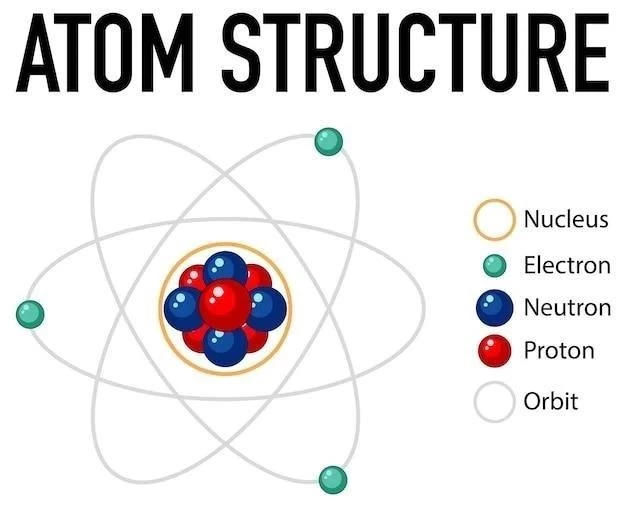
Ce postulat stipule que les atomes sont les unités fondamentales et indivisibles de la matière. Dalton pensait que les atomes étaient les plus petites particules possibles d’un élément. Cependant, des découvertes ultérieures ont révélé que les atomes sont en réalité constitués de particules subatomiques encore plus petites. Ces particules subatomiques sont les protons, les neutrons et les électrons.
Les protons et les neutrons se trouvent dans le noyau de l’atome, tandis que les électrons orbitent autour du noyau. Les protons portent une charge positive, les neutrons sont neutres et les électrons portent une charge négative. Le nombre de protons dans un atome détermine son numéro atomique et son identité chimique. Le nombre de neutrons peut varier, ce qui donne lieu aux isotopes.
La découverte des particules subatomiques a remis en question le postulat 8 de Dalton. Cependant, il reste important de reconnaître que les atomes sont les plus petites unités d’un élément qui peuvent participer à des réactions chimiques. Les particules subatomiques ne peuvent pas exister seules et ne peuvent pas être séparées par des moyens chimiques ordinaires.
Postulat 9⁚ Les atomes d’un élément ne peuvent être transformés en atomes d’un autre élément
Ce postulat, connu sous le nom de loi de conservation de l’élément, stipule que les atomes d’un élément donné ne peuvent pas être transformés en atomes d’un autre élément par des réactions chimiques ordinaires. En d’autres termes, la matière ne peut pas être créée ni détruite, elle est simplement transformée d’une forme à une autre.
Ce postulat est crucial pour comprendre les réactions chimiques. Il explique pourquoi les réactions chimiques ne peuvent pas créer de nouveaux éléments, mais seulement réarranger les atomes existants. Par exemple, lorsque du bois brûle, il ne disparaît pas, mais se transforme en cendres, en gaz carbonique et en vapeur d’eau. Les atomes de carbone, d’hydrogène et d’oxygène qui composaient le bois sont toujours présents, mais ils sont simplement réarrangés en nouvelles molécules.
Il est important de noter que ce postulat ne s’applique pas aux réactions nucléaires. Les réactions nucléaires, telles que la fission nucléaire, peuvent effectivement transformer des atomes d’un élément en atomes d’un autre élément. Cependant, ces réactions sont beaucoup plus énergétiques que les réactions chimiques ordinaires et ne sont pas régies par les mêmes principes.
Les Lois Chimiques Fondamentales
La théorie atomique de Dalton a non seulement fourni une explication cohérente de la structure de la matière, mais elle a également permis de comprendre et d’expliquer plusieurs lois chimiques fondamentales qui avaient été observées expérimentalement avant sa formulation. Ces lois, qui étaient auparavant des observations empiriques, ont trouvé leur base théorique dans les postulats de Dalton. Voici les trois lois chimiques fondamentales qui ont été expliquées par la théorie atomique de Dalton⁚
- La loi de conservation de la masse
- La loi des proportions définies
- La loi des proportions multiples
Ces lois ont joué un rôle crucial dans le développement de la chimie moderne et ont permis de mieux comprendre les réactions chimiques et les compositions des substances.
La loi de conservation de la masse
La loi de conservation de la masse, énoncée par Antoine Lavoisier à la fin du XVIIIe siècle, stipule que dans une réaction chimique, la masse totale des réactifs est égale à la masse totale des produits. En d’autres termes, la masse ne peut être ni créée ni détruite dans une réaction chimique. Cette loi est une conséquence directe du postulat de Dalton selon lequel les atomes ne peuvent être ni créés ni détruits.
Lors d’une réaction chimique, les atomes ne sont pas perdus ou gagnés, mais simplement réarrangés. Ainsi, la masse totale des atomes avant la réaction est la même que la masse totale des atomes après la réaction. Cela explique pourquoi la masse totale des réactifs est égale à la masse totale des produits. La loi de conservation de la masse est un principe fondamental de la chimie et joue un rôle essentiel dans l’analyse et la compréhension des réactions chimiques.
La loi des proportions définies
La loi des proportions définies, également connue sous le nom de loi de Proust, stipule que la composition d’un composé chimique donné est toujours la même, quel que soit son origine ou sa méthode de préparation. En d’autres termes, les éléments qui constituent un composé sont toujours présents dans les mêmes proportions en masse. Cette loi est une conséquence directe du postulat de Dalton selon lequel les atomes d’un élément donné sont identiques en masse et en propriétés.
Par exemple, l’eau (H2O) est toujours composée de deux atomes d’hydrogène et d’un atome d’oxygène, quelle que soit sa source. La proportion en masse d’hydrogène et d’oxygène dans l’eau est toujours de 11,1 % pour l’hydrogène et de 88,9 % pour l’oxygène. Cette loi a permis aux chimistes de déterminer la composition des composés et de les caractériser de manière précise. La loi des proportions définies est donc un outil fondamental pour l’analyse chimique et la synthèse de nouvelles substances.
La loi des proportions multiples
La loi des proportions multiples, énoncée par Dalton en 1803, stipule que lorsque deux éléments se combinent pour former plusieurs composés différents, les masses de l’un des éléments qui se combinent avec une masse fixe de l’autre élément sont dans un rapport de nombres entiers simples. Cette loi est une extension de la loi des proportions définies et fournit un autre support à l’idée que la matière est composée d’atomes.
Par exemple, considérons les deux oxydes de carbone, le monoxyde de carbone (CO) et le dioxyde de carbone (CO2). Dans le monoxyde de carbone, 12 grammes de carbone se combinent avec 16 grammes d’oxygène, tandis que dans le dioxyde de carbone, 12 grammes de carbone se combinent avec 32 grammes d’oxygène. Le rapport des masses d’oxygène qui se combinent avec une masse fixe de carbone (12 grammes) est de 16⁚32, soit 1⁚2. Cela signifie que le dioxyde de carbone contient deux fois plus d’atomes d’oxygène que le monoxyde de carbone, conformément à la théorie atomique de Dalton.
L’article est un excellent résumé de la théorie atomique de Dalton. L’auteur souligne l’importance de cette théorie pour la compréhension de la matière et son comportement. Il serait intéressant d’ajouter une section sur les contributions de Dalton à la philosophie des sciences et à l’épistémologie.
La présentation de la théorie atomique de Dalton est bien structurée et informative. L’auteur met en évidence l’importance historique de cette théorie et son impact sur le développement de la chimie moderne. Il serait toutefois pertinent de développer davantage les applications pratiques de la théorie de Dalton, notamment en chimie organique et en chimie inorganique.
L’article est clair et concis, offrant une bonne compréhension de la théorie atomique de Dalton. L’auteur met en évidence l’importance historique de cette théorie et son influence sur le développement de la chimie. Il serait intéressant d’ajouter des illustrations visuelles pour mieux illustrer les concepts de la théorie, telles que des schémas de molécules et des réactions chimiques.
L’article est bien documenté et fournit une analyse complète de la théorie atomique de Dalton. L’auteur présente les postulats de la théorie de manière claire et précise. Il serait pertinent d’ajouter une section sur les applications contemporaines de la théorie atomique, notamment en nanotechnologie et en science des matériaux.
Cet article offre une introduction claire et concise à la théorie atomique de Dalton. L’auteur présente les postulats de la théorie de manière accessible et précise. Cependant, il serait intéressant d’ajouter une section sur les limites de la théorie de Dalton, notamment en ce qui concerne la découverte des isotopes et des réactions nucléaires. L’inclusion d’une brève discussion sur l’évolution de la théorie atomique depuis Dalton enrichirait l’article.
L’article offre une synthèse complète de la théorie atomique de Dalton. L’auteur met en lumière l’importance de cette théorie pour la chimie moderne. Il serait intéressant d’ajouter une section sur les contributions de Dalton à d’autres domaines scientifiques, tels que la météorologie et la physique.
L’article présente de manière concise et précise les principaux postulats de la théorie atomique de Dalton. La clarté de l’écriture et l’organisation logique des informations facilitent la compréhension du sujet. Il serait pertinent d’aborder les implications de la théorie de Dalton sur la compréhension de la structure et des propriétés des molécules.
L’article est un excellent point de départ pour comprendre la théorie atomique de Dalton. L’auteur présente les postulats de la théorie de manière accessible et précise. Il serait intéressant d’ajouter une section sur les implications de la théorie de Dalton pour la compréhension de la structure et des propriétés des éléments et des composés.
L’article est un excellent point de départ pour comprendre les fondements de la théorie atomique de Dalton. L’auteur souligne l’importance des observations expérimentales et des raisonnements logiques qui ont mené à la formulation de cette théorie. Il serait intéressant d’ajouter des exemples concrets illustrant les postulats de la théorie, tels que des réactions chimiques simples.
L’article est bien écrit et fournit une introduction solide à la théorie atomique de Dalton. L’auteur met en évidence les concepts clés de la théorie et son impact sur la compréhension de la matière. Il serait pertinent d’inclure une brève discussion sur les controverses qui ont entouré la théorie de Dalton et son évolution au fil du temps.
L’article est bien écrit et offre une synthèse claire et concise de la théorie atomique de Dalton. L’auteur met en évidence l’importance de cette théorie pour la chimie moderne. Il serait pertinent d’ajouter une section sur les liens entre la théorie atomique de Dalton et les théories atomiques ultérieures, telles que le modèle de Bohr et la mécanique quantique.